글로벌 연구동향
핵의학
- 2023년 01월호
[Small Methods.] Spatial Transcriptomics-Based Identification of Molecular Markers for Nanomedicine Distribution in Tumor Tissue종양내 나노약물분포에 대한 분자마커의 공간기반식별서울대 / 박정빈, 최진영, 최홍윤*, 임형준*
- 출처
- Small Methods.
- 등재일
- 2022 Nov
- 저널이슈번호
- 6(11):e2201091. doi: 10.1002/smtd.202201091. Epub 2022 Sep 30.
- 내용
-
Abstract
The intratumoral accumulation of nanomedicine has been considered a passive process, referred to as the enhanced permeability and retention effect. Recent studies have suggested that the tumor uptake of nanomedicines follows an energy-dependent pathway rather than being a passive process. Herein, to explore the factor candidates that are associated with nanomedicine tumor uptake, a molecular marker identification platform is developed by integrating microscopic fluorescence images of a nanomedicine distribution with spatial transcriptomics information. When this approach is applied to PEGylated liposomes, molecular markers related to hypoxia, glycolysis, and apoptosis can be identified as being related to the intratumoral distribution of the nanomedicine. It is expected that the method can be applied to explain the distribution of a wide range of nanomedicines and that the data obtained from this analysis can enhance the precise utilization of nanomedicines.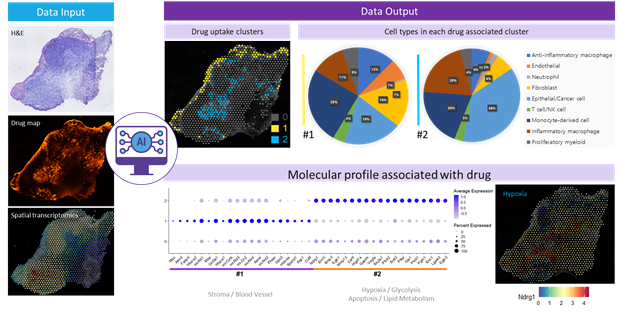
Affiliations
Jeongbin Park 1, Jinyeong Choi 2, Jae Eun Lee 3, Hongyoon Choi 4 5, Hyung-Jun Im 1 2 6 7
1Department of Molecular Medicine and Biopharmaceutical Sciences, Graduate School of Convergence Science and Technology, Seoul National University, Seoul, 08826, Republic of Korea.
2Department of Applied Bioengineering, Graduate School of Convergence Science and Technology, Seoul National University, Seoul, 08826, Republic of Korea.
3Portrai Inc, Seoul, 03136, Republic of Korea.
4Department of Nuclear Medicine, Seoul National University College of Medicine, Seoul, 03080, Republic of Korea.
5Department of Nuclear Medicine, Seoul National University Hospital, Seoul, 03080, Republic of Korea.
6Cancer Research Institute, Seoul National University, Seoul, 03080, Republic of Korea.
7Research Institute for Convergence Science, Seoul National University, Seoul, 08826, Republic of Korea.
- 키워드
- apoptosis; enhanced permeability and retention; glycolysis; hypoxia; lipid nanoplatforms; molecular markers; spatial transcriptomics.
- 연구소개
- 이 연구는 2020년 1월 Nature Materials에 게재된 「The entry of nanoparticles into solid tumours」에서 직접적인 모티브를 얻었습니다. 이 논문에서는 고형암 내 나노입자의 분포는 수동적 섭취가 아니라 능동적 섭취라는 것을 강하게 시사하였습니다. 이로 인해, 나노입자가 종양 및 염증성 병변의 성긴 조직을 따라 수동적으로 섭취된다는 enhanced permeability and retention (EPR) 효과를 정면으로 반박하였습니다. 하지만, 리포좀이 종양 내 높게 섭취되는 요인을 살펴보았을 때 blood circulation을 높이는 PEG percentage만 도출될 뿐 그 밖의 요인에서는 통계적 유의성이 나타나지 않았습니다 (J Nucl Med 2016; 57: 601-607). 따라서 단순히 EPR 효과를 재반박하는 것을 넘어 어떤 분자적 마커가 구체적으로 조직 내 나노입자 섭취에 관여하는지를 확인하기 위해 2020년 Nature Methods에서 올해의 기술로 선정된 차세대 시퀀싱 기술(next-generation sequencing, NGS)인 공간전사체(spatial transcriptomics, ST)를 도입하였습니다. Balb/c 마우스 오른쪽 넓적다리에 4T1 세포를 주입하여 종양 모델을 생성하였습니다. 그 뒤, 형광 리포좀을 꼬리 정맥을 통해 주입하여 형광 리포좀이 들어간 종양 조직을 추출하였습니다. 10X Visium 프로토콜에 따라 tissue frozen block 및 조직 슬라이스를 획득하여, 최종적으로 종양 내 형광 리포좀의 분포 이미지와 이와 대응되는 2차원 공간전사체 데이터 및 H&E 이미지를 얻었습니다. 이때 2차원 공간전사체 데이터는 스팟 개수 1,229개, 유전자 개수 32,285개, 표면적 6.5 mm × 6.5 mm, 두께 10 ~ 20 μm, 스팟 간 거리 100 μm, 그리고 스팟 직경 55 μm를 특징으로 하였습니다. 형광 이미지와 각 유전자별 공간전사체 데이터를 spotwise correlation analysis를 수행하여 어떤 유전자가 조직 내 형광 분포와 연관돼 있는지를 얻었습니다. 이 과정에서 SPADE 알고리즘, CellDART 알고리즘, image-based clustering 등 유수의 딥러닝 알고리즘 수요가 확인되었습니다. 또한, 조직별로 섭취 패턴이 다르다는 것을 여러 차례의 시행착오 끝에 알 수 있었습니다. 이에 image-based clustering을 도입하여 형광 이미지에서 섭취 패턴을 외부 섭취와 내부 섭취로 구분할 수 있었고, 각 섭취 클러스터에서의 연관 유전자를 획득하였습니다. 그 결과, 표면 섭취는 혈류와 extracellular matrix (ECM) 관련 유전자들이 많이 관찰되었고, 심층 분석 결과 수동적 섭취인 것으로 나타났습니다. 이에 반해 내부 섭취는 hypoxia, glycolysis, apoptosis와 같은 gene ontology (GO)가 관찰되었고, 능동적 섭취인 것으로 나타났습니다. 여기서 소개된 분자적 마커 도출 방법은 아래 그림과 같이 요약될 수 있습니다.
- 덧글달기
- 이전글 [Anticancer Res] A Machine Learning Approach Using PET/CT-based Radiomics for Prediction of PD-L1 Expression in Non-small Cell Lung Cancer
- 다음글 [Cells .] Different Expression of Thyroid-Specific Proteins in Thyroid Cancer Cells between 2-Dimensional (2D) and 3-Dimensional (3D) Culture Environment







편집위원
나노크기의 입자의 의학적 이용에는 많은 장점이 있으며, 나노크기 입자는 종양에 의해 증가된 투과력과 이어진 정체로 인해 수동적으로 조양에 축적된다고 알려져 왔으나 최근에는 에너지 관련된 방식으로 축적될 가능성도 제안되고 있다. 해당 연구는 나노크기의 입자의 종양내 분포를 평가할 수 있는 현미경적 형광영상을 도입하였다. 해당 연구기법은 나노의학에 관심이 있는 다양한 영역의 전문가의 관심을 끌 흥미로운 연구로 생각된다.
덧글달기닫기2023-01-06 15:04:11
등록
편집위원2
공간기반식별법을 이용하여 종양내 나노약물분포에 대한 분자마커의 식별에 대한 연구로, energy dependent pathway, hypoxia, glycolysis, apoptosis 등의 작용들과 연계하여 신약개발 및 나노정밀의료에 높이 기여할 수 있을 것으로 기대됨.
덧글달기닫기2023-01-06 15:04:41
등록
편집위원3
나노의약품의 종양 표적은 EPR 효과 (Enhanced Permeability and Retention effect)를 통해 수동적인 종양내 축적 과정으로 알려져 왔으나, 최근 연구에서는 수동적 EPR 효과 보다는 에너지 의존적인 경로를 따른다고 한다. 이 논문은 나노의약품의 섭취과정을 설명하기 위해, 나노물질의 종양 섭취와 관련된 인자 후보 탐색을 위한 분자 마커 식별 플랫폼 (molecular marker identification platform)의 개발에 대해 설명하고 있고, 결과적으로 나노의약품 개발 및 활용 연구에 도움이 될 수 있을 것으로 기대된다.
덧글달기닫기2023-01-06 15:20:24
등록