글로벌 연구동향
방사선종양학
- [Radiother Oncol] High ratio of programmed cell death protein 1 (PD-1)(+)/CD8(+) tumor-infiltrating lymphocytes identifies a poor prognostic subset of extrahepatic bile duct cancer undergoing surgery
서울의대 / 김규보*
- 출처
- Radiother Oncol
- 등재일
- 2015 Oct
- 저널이슈번호
- 117(1):165-70. doi: 10.1016/j.radonc.2015.07.003. Epub 2015 Jul 30.
- 내용
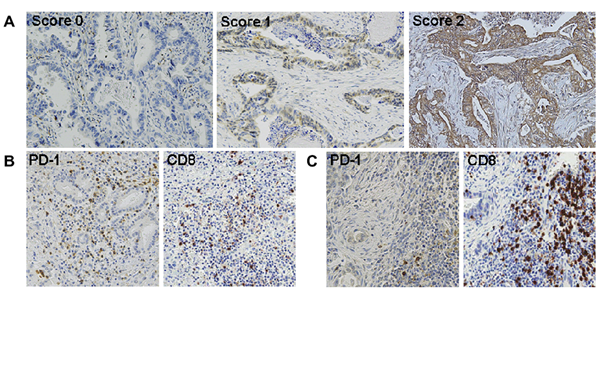
그림 1. (A) PD-L1 면역조직화학염색 결과의 대표 슬라이드 (B) PD-1+/CD8+ TIL 비율이 높은 종양의 PD-1, CD8 면역조직화학염색 결과 (C) PD-1+/CD8+ TIL 비율이 낮은 종양의 PD-1, CD8 면역조직화학염색 결과
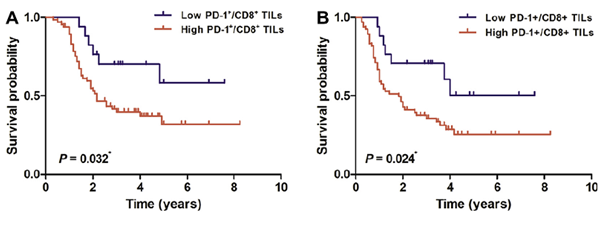
그림 2. PD-1+/CD8+ TIL 비율에 따른 생존 곡선 비교 (A) 전체 생존율 (B) 무재발 생존율
Abstract
BACKGROUND AND PURPOSE:
This study investigated the prognostic role of PD-L1 expression, PD-1(+) tumor-infiltrating lymphocytes (TILs), and the ratio of PD-1(+)/CD8(+) TILs in extrahepatic bile duct (EHBD) cancer.
MATERIALS AND METHODS:
We analyzed 83 patients with EHBD cancer who underwent curative surgery plus fluoropyrimidine-based chemoradiotherapy (CRT). Expressions of PD-L1, PD-1, and CD8 were assessed by immunohistochemistry.
RESULTS:
Fifty-six (68%) patients were PD-L1-positive, and its lower expression level was associated with hilar tumor location (P=0.044). A higher ratio of PD-1(+)/CD8(+) TILs was associated with poorer overall survival (OS) (P=0.032), relapse-free survival (RFS) (P=0.024), and distant metastasis-free survival (DMFS) (P=0.039) in Kaplan-Meier analyses, but survival differences were not observed according to the PD-L1 expression level. With Cox proportional hazards models, the ratio of PD-1(+)/CD8(+) TILs was the independent prognostic factor in OS (HR 2.47, 95% CI 1.04-5.86), RFS (HR 2.41, 95% CI 1.08-5.41), and DMFS (HR 2.67, 95% CI 1.00-7.11) after adjusting for other significant clinicopathologic variables.
CONCLUSION:
A strong survival impact of the ratio of PD-1(+)/CD8(+) TILs was observed in EHBD cancer. In the poor prognostic subgroup, the blockade of the immune checkpoint in combination with conventional multimodality treatment needs to be considered.
Author information
Lim YJ1, Koh J2, Kim K3, Chie EK4, Kim B5, Lee KB6, Jang JY7, Kim SW8, Oh DY9, Bang YJ10, Ha SW11.
1Department of Radiation Oncology, Seoul National University College of Medicine, Republic of Korea. Electronic address: yujindw@gmail.com.
2Department of Pathology, Seoul National University College of Medicine, Republic of Korea. Electronic address: tarda@naver.com.
3Department of Radiation Oncology, Seoul National University College of Medicine, Republic of Korea. Electronic address: kyubokim@snu.ac.kr.
4Department of Radiation Oncology, Seoul National University College of Medicine, Republic of Korea; Institute of Radiation Medicine, Medical Research Center, Seoul National University, Republic of Korea. Electronic address: ekchie93@snu.ac.kr.
5Department of Radiation Oncology, Seoul National University College of Medicine, Republic of Korea. Electronic address: merdeglas@hanmail.net.
6Department of Pathology, Seoul National University College of Medicine, Republic of Korea. Electronic address: kblee@snuh.org.
7Department of Surgery, Seoul National University College of Medicine, Republic of Korea. Electronic address: jangjy4@gmail.com.
8Department of Surgery, Seoul National University College of Medicine, Republic of Korea. Electronic address: sunkim@snu.ac.kr.
9Department of Internal Medicine, Seoul National University College of Medicine, Republic of Korea. Electronic address: ohdoyoun@snu.ac.kr.
10Department of Internal Medicine, Seoul National University College of Medicine, Republic of Korea. Electronic address: bangyj@snu.ac.kr.
11Department of Radiation Oncology, Seoul National University College of Medicine, Republic of Korea; Institute of Radiation Medicine, Medical Research Center, Seoul National University, Republic of Korea. Electronic address: swha@snu.ac.kr.
- 키워드
- Adjuvant chemoradiotherapy; Bile duct neoplasms; CD8; Programmed cell death 1 ligand 1 protein; Programmed cell death 1 protein
- 연구소개
- 간외담도암은 수술, 항암화학요법, 방사선치료 등의 다학제적 접근에도 불구하고 나쁜 생존 결과를 보이는 것으로 알려져 있고, 다른 암종에 비해 활용 가능한 표적 치료에 관한 정보가 충분하지 않다. 종양면역학에서는 치료에 적용 가능한 표적 대상으로 immune checkpoint에 주목하고 있는데, 이러한 checkpoint의 활성화는 효과 T 세포 (effector T cell) 의 기능을 억제하여 종양 특이 면역 반응을 감소시키는 역할을 한다. Programmed cell death protein 1 (PD-1)/programmed cell death protein ligand 1 (PD-L1)은 최근에 대표적으로 연구되고 있는 checkpoint molecule이다. 2009년도에 간내담도암에서 PD-1/PD-L1 발현과 임상병리학적 인자들 간의 관련성을 살펴보는 연구 결과가 발표된 바 있다. 하지만 당시 생존 결과와의 관련성에 관한 분석은 수행되지 않았으며, 이후의 후속 연구나 간외담도암에서의 결과는 발표된 바가 없었다. 이에 본 연구진은 근치적 수술 후 항암방사선 치료를 시행 받은 간외담도암 환자 83명의 tissue microarray를 이용하여 PD-1, PD-L1, CD8에 대한 면역조직화학염색을 시행했고, 면역 관련 인자들의 발현도와 생존 분석 결과와의 관련성에 대해 살펴보고자 했다. 분석 결과, PD-1, PD-L1 각각의 단독 발현도와 예후간의 관계는 관찰되지 않았으나, PD-1+/CD8+ 종양 침윤 림프구 (tumor-infiltrating lymphocytes, TIL) 비율이 높은 환자들에서 전체 생존율, 무재발 생존율, 무전이 생존율이 모두 유의하게 낮은 것으로 나타났으며, 이는 다변량 분석에서도 유의하게 관찰되었다. 이를 통해 PD-1+/CD8+ TIL 비율이 높은 간외담도암 환자들에서는 수술 후 항암방사선치료에도 불구하고 나쁜 예후 결과가 예상됨을 확인할 수 있었고, 이러한 환자군에서 PD-1/PD-L1 억제 치료를 통해 종양 특이 면역 반응을 향상시킨다면 보다 좋은 생존 결과를 얻을 수 있을 것이라고 결론 내렸다
- 덧글달기
- 이전글 [Clin Breast Cancer] Differences in Prognostic Factors and Failure Patterns Between Invasive Micropapillary Carcinoma and Carcinoma With Micropapillary Component Versus Invasive Ductal Carcinoma of th
- 다음글 Indirect Tumor Cell Death After High-Dose Hypofractionated Irradiation: Implications for Stereotactic Body Radiation Therapy and Stereotactic Radiation Surgery.